細胞の機能維持において細胞増殖、分化、細胞死の決定は極めて重要である。我々が研究対象にしているイノシトールリン脂質代謝は、細胞膜直下で主にカルシウム動態を制御する代謝系であり、生命の基本的機能である細胞増殖、分化などの制御に深く関わっている。この代謝系では、ホスファチジルイノシトール4,5二リン酸(PIP2)がホスホリパーゼC(PLC)で分解されることがトリガーとなり、2つのセカンドメッセンジャーであるイノシトール1,4,5-三リン酸(IP3)とジアシルグリセロール(DAG)が産生される。IP3は小胞体からのカルシウム放出を、またDAGはプロテインキナーゼC(PKC)を活性化する事により様々な生理機能を制御する。従ってイノシトールリン脂質代謝は、生命の根幹を司るカルシウム動態を制御する代謝系とも言える。またPIP2自体も細胞骨格を調節する事により多様な生理機能を有している。
我々はPLCδタイプの遺伝子欠損マウスを網羅的に作製し、細胞増殖、分化、細胞死の制御の破綻がもたらす様々な疾患を報告してきた。PLCδ1は増殖と分化を制御し皮膚の恒常性維持や肥満形成、そして大腸がんの悪性化抑制に重要な働きを持つこと(EMBO J. 22, 2981-2991(2003);Biochem. Biophys. Res. Comm. 356, 912-8 (2007); FASEB J. 22, 841-849(2008); Diabetes 60, 1926-37 (2011); Nature Commun. 3, 963 (2012), Cell Death & Disease 5, e1215 (2014), Proc. Natl. Acad. Sci. USA. 111, 13505-13510 (2014))、PLCδ4はカルシウム制御を介して受精時の精子先体反応(卵の透明帯を通過するための反応)に不可欠であること(Science 292, 920-923 (2001);J. Cell Biol. 161, 79-88 (2003))、PLCδ1/PLCδ3の2つの遺伝子を欠損したマウスは胎盤を構成する細胞の細胞死が亢進し胎盤形成不全により胎生致死となることから、PLCδ1/PLCδ3は胎盤形成を介した個体発生に不可欠であること(Mol. Cell. Biol. 25, 10979-10988 (2005))など、生命現象におけるPLCδタイプの普遍的重要性を明らかにしてきた。こうした事実は、リン脂質代謝が増殖・分化の分岐点での幹細胞の運命決定に深く関与する事を示している。
こうした結果を基に現在我々は、上皮系組織の増殖と分化制御とその破綻がもたらす病態発症のメカニズムに焦点を当てている。特に皮膚疾患やがん細胞の浸潤転移などの悪性化機構の解析を行っている。また異なる細胞・組織間での多岐に渡るイノシトールリン脂質代謝の機能を知ることにより、リン脂質代謝の持つ本質的・普遍的概念を明らかにしたいと考えている。疾病のメカニズム解明から、創薬等治療へ貢献し得る応用性に繋げることが最終目標である。
皮膚は、外界と体内を物理的に遮断し、外部のさまざまな刺激から体内を守るバリアとして働く重要な組織である。皮膚の最外層に位置する表皮は主に表皮角化細胞によって構成された重層構造をなしており、表皮角化細胞の増殖、分化の厳密な制御によってその構造が維持されている。表皮の内側には真皮があり、その主要な構成成分は真皮線維芽細胞から作られるコラーゲンなどの細胞外基質である。また、皮膚炎症時には皮膚へ各種の免疫担当細胞が浸潤し、サイトカイン等の産生を介し、表皮角化細胞、真皮線維芽細胞をはじめとした皮膚構成細胞に様々な影響を与える。表皮角化細胞、真皮線維芽細胞、免疫担当細胞の機能は多様な細胞内情報伝達系により調節を受けており、こうした制御の破綻は炎症性皮膚疾患の一因となる。細胞膜構成脂質の一種であるPIの代謝系は表皮角化細胞、真皮線維芽細胞、免疫担当細胞等の機能調節に重要な役割を担う細胞内情報伝達系の一つとして働いている。
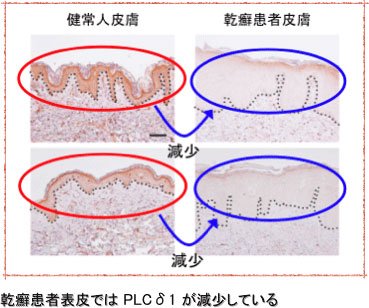
我々は、乾癬やアトピー性皮膚炎などの炎症性皮膚疾患におけるPI代謝酵素の役割についてPI代謝酵素KOマウス、各種皮膚疾患モデルマウス、ヒト初代培養表皮角化細胞、三次元培養人工ヒト皮膚モデル、ヒト皮膚疾患臨床検体など様々な解析系を用いて研究を行っている。これまでにPI代謝酵素PLCδ1が炎症性皮膚疾患の発症や悪化に対し抑制的に働いている可能性を見出しており、今後PLCδ1をはじめとした各種PI代謝酵素と炎症性皮膚疾患との関連について研究を進めることにより、乾癬やアトピー性皮膚炎などの炎症性皮膚疾患に対する新たな治療標的を見出すことを目的としている。
上皮間葉形質転換 (Epithelial-Mesenchymal Transitions: EMT) は、初期発生における組織形成において必須の現象であり、原腸陥入や神経冠細胞の形成に関与している。EMTは、上皮性のがん細胞が悪性化する際にも観察され、EMTを起こした細胞は上皮としての性質を失い、転移能が亢進すると共に、自己増殖能や薬剤耐性も亢進することから、EMTはがん悪性化機構として注目されている重要な機構である。
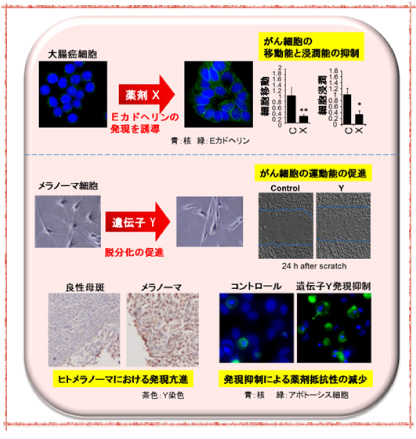
我々は、EMTの指標であり、制御因子でもあるE-カドヘリンの発現に着目し、EMTを制御する遺伝子や薬剤の探索を行っている。
これまでに、E-カドヘリン発現を指標とした、
1. 低分子化合物ライブラリー等のスクリーニング
2. 神経冠形成遺伝子群に対するsiRNAスクリーニング
を行い、E-カドヘリンの発現を顕著に誘導する化合物や、E-カドヘリン発現を抑制しがん悪性化を促進する遺伝子の同定に成功している。これらの因子の作用機序や分子メカニズムを解析することで、がん治療につながる分子基盤を得ることを目的としている。
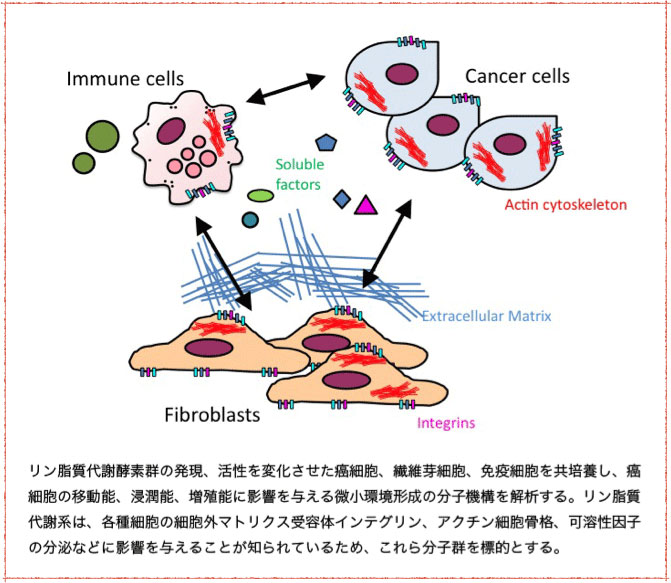
細胞を取り囲んでいる細胞外マトリクス(ECM)は、創傷治癒や癌微小環境形成等様々な生理機能に重要な役割を果たす。線維芽細胞、免疫細胞など複数の細胞系からなるin vitroでのがん微小環境を構築し、各構成細胞でのリン脂質代謝酵素群の発現、活性を変化させることで微小環境形成の分子機構を明らかにすること、微小環境を改変する技術を確立することを目指している。リン脂質代謝関連酵素群の他、ECM受容体インテグリン、アクチン細胞骨格制御因子も研究ターゲットにしている。